|
Εισαγωγή
- Σύμπλεγμα Οζώδους Σκλήρυνσης και Λεμφαγγειο- λειομυομάτωση
- TSC1 και TSC2
- Μιτωτική φωσφορυλίωση της TSC1
- Κεντροσώματα
- Ανευπλοειδία
- Χρηματοδότηση και ευαισθητοποίηση του κοινού
Τρέχοντα προγράμματα
- Ρόλος της αλληλεπίδρασης PLK1-TSC1 στην Οζώδη Σκλήρυνσης
- Ανακάλυψη φαρμάκευτικών ουσιών για την Οζώδη Σκλήρυνση
|
|
Εισαγωγή
Σύμπλεγμα Οζώδους Σκλήρυνσης (TSC)
Το Σύμπλεγμα Οζώδους Σκλήρυνσης επηρεάζει 1 σε κάθε 6.000-10.000
άτομα. Είναι σύνδρομο ογκοκατασταλτικών γονιδίων με εμφάνιση καλοήθων
όγκων σε πολλαπλά όργανα, συμπεριλαμβανόμενου του εγκεφάλου, δέρματος,
νεφρού, αμφιβληστροειδούς, και καρδιάς. Η TSC προκαλείται από μεταλλάξεις
στα ογκοκατασταλτικά γονίδια TSC1 και TSC2. Παρ'όλο
που δεν υπάρχει ισχυρή συσχέτιση γενότυπου/φαινότυπου, οι περιπτώσεις
με μεταλλάξεις στο TSC2 φαίνεται να είναι ποιό σοβαρές. Η
σοβαρότητα των συμπτωμάτων είναι ποικίλλει, με ορισμένους ασθενείς
να επηρεάζονται ήπια και άλλους με σοβαρή νοητική ή αναπτυξιακή
υστέρηση. Η θεραπεία είναι συμπτωματική. Ο προσδιορισμός του mTOR
ως καθοδικού στόχου των TSC1 και TSC2, οδήγησε στις πρώτες κλινικές
δοκιμές του αναστολέα του mTOR ραπαμυκίνη ως θεραπευτική επιλογή
για την TSC.
Λεμφαγγειολειομυομάτωση (LAM)
Η σποραδική Λεμφαγγειολειομυομάτωση είναι σπάνια ασθένεια που επηρεάζει
αποκλειστικά γυναίκες. Προκαλείται από πολλαπλασιασμό λείων μυϊκών
κυττάρων στους πνεύμονες. Οι ασθενείς εμφανίζουν δύσπνοια, γίνονται
εξαρτώμενοι από οξυγόνο, και συχνά έχουν πολλαπλούς πνευμοθώρακες.
Ασθενείς τελικού σταδίου υποβάλλονται σε μεταμόσχευση πνεύμονα.
Η LAM προκαλείται από μεταλλάξεις στα TSC1 και TSC2.
Τα ογκοκατασταλτικά γονίδια TSC1 και TSC2
Τα ογκοκατασταλτικά γονίδια TSC1 και TSC2 μεταλλάσσονται στο
Σύμπλεγμα Οζώδους Σκλήρυνσης και την πνευμονική Λεμφαγγειολειομυομάτωση.
Κωδικοποιούν δυο πρωτεΐνες που ονομάζονται αμαρτίνη και οζωδίνη,
αντίστοιχα. Στο COOH-τελικό της άκρο η οζωδίνη (TSC2, 200 kDa) έχει
μια περιοχή ομολογίας με πρωτεΐνες που ενεργοποιούν GTPάσες (GAP).
Στο COOH-τελικό της άκρο η αμαρτίνη (TSC1, 130 kDa) έχει μια περιοχή
που ενεργοποιεί την RhoA. Οι TSC1 και TSC2 σχηματίζουν ετεροδιμερή,
συν-εντοπίζονται και συν-ανοσοκαθιζάνουν.
Η TSC2 ρυθμίζει αρνητικά τη μικρή GTPάση Rheb (Εικόνα 1, ανασκόπηση
Astrinidis
and Henske 2005 Oncogene). Μετά από διέγερση από αυξητικούς
παράγοντες η TSC2 υπόκειται ανασταλτική φωσφορυλίωση από πολλαπλές
κινάσες, συμπεριλαμβανομένων των AKT/PKB, ERK1/2 και MK2, που οδηγούν
στην ενεργοποίηση της Rheb και στην αύξηση της δραστικότητας του
ευκαρυωτικού στόχου ραπαμυκίνης (mammalian target of rapamycin,
mTOR) ο οποίος ρυθμίζει μετάφραση mRNA, βιογένεση ριβοσωμάτων, κυτταρική
ανάπτυξη, αυτοφαγία, αγγειογένεση και απόπτωση. Επιπρόσθετα, η Rheb
ρυθμίζει αρνητικά την κινάση B-Raf, η οποία συμμετέχει σε διεργασίες
διαφοροποίησης. Μετά από στέρηση ενέργειας και υποξία, η TSC2 ρυθμίζεται
θετικά από την AMPK. Επομένως, το σύμπλοκο TSC1/TSC2 παίζει κεντρικό
ρόλο στην ενσωμάτωση σημάτων από διαφορετικά εξωκυττάρια ερεθίσματα.
|
|
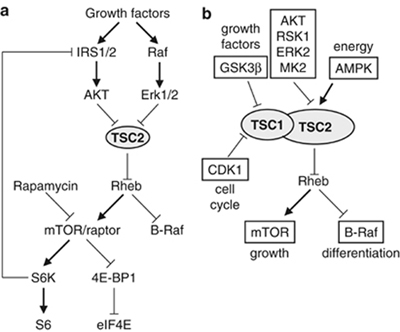
Εικόνα 1. (a) Ρύθμιση του μονοπατιού TSC2/Rheb/mTOR από
αυξητικούς παράγοντες. (b) Ενσωμάτωση σημάτων από αυξητικούς παράγοντες,
ενέργεια και κυτταρικό κύκλο μέσω της φωσφορυλίωσης του συμπλόκου
TSC1/TSC2 (Astrinidis
and Henske 2005 Oncogene).
Η αμαρτίνη φωσφορυλιώνεται κατά τη μίτωση
Προηγουμένως δείξαμε πως η TSC1 φωσφορυλιώνεται από το σύμπλοκο
CDK1/cyclin B1 κατά τη μετάβαση του κυτταρικού κύκλου στο σημείο
G2/M. Αυτή η φωσφορυλίωση ρυθμίζει αρνητικά τη δραστηριότητα του
σύμπλοκου TSC1/TSC2 ως προς το mTOR (Astrinidis
et al. 2003 J. Biol. Chem.).
Πρόσφατα βρήκαμε πως το σύμπλοκο TSC1/TSC2 αλληλεπιδρά με τη μιτωτική
κινάση PLK1 (Εικόνα 2). Αυτή η αλληλεπίδραση γίνεται με τη μεσολάβηση
του κατάλοιπου T310 της TSC1 (Astrinidis
et al. 2006 Hum. Mol. Genet.). Επί του παρόντος ερευνούμε το
ρόλο της αλληλεπίδρασης TSC1-PLK1 στη μιτωτική διεργασία και κυτταροκίνηση
μέσω της ρύθμισης του mTOR και της RhoA.
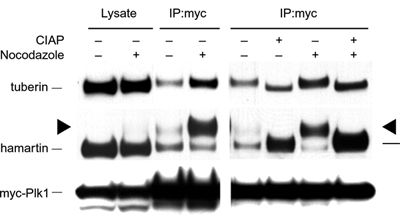 |
Εικόνα 2. Ανοσοαποτύπωση δειγμάτων κυττάρων HEK293 ελέγχου
ή μετά από επώαση με nocodazole, και ανοσοσυμπλόκων PLK1 χωρίς ή
με εντερική αλκαλική φωσφατάση μόσχου (CIAP). Η TSC1 συν-ανοσοκαθιζάνει
με την PLK1. Η TSC1 στα ανοσοκοσύμπλοκα της PLK1 είναι φωσφορυλιωμένη
εκτενώς (Astrinidis
et al. 2006 Hum. Mol. Genet.).
Η ενεργοποίηση του mTOR προκαλεί πολλαπλασιασμό κεντροσωμάτων
Βρήκαμε πως η αμαρτίνη (TSC1) εντοπίζεται στα κεντροσώματα (Εικόνα
3), και πως απώλεια της αμαρτίνης στα κύτταρα οδηγεί σε αυξημένο
αριθμό κεντροσωμάτων (Εικόνα 4). Προεπώαση κυττάρων που δεν έχουν
αμαρτίνη με τον αναστολέα του mTOR ραπαμυκίνη διασώζει τον φαινότυπο
αυξημένων κεντροσωμάτων (Astrinidis
et al. 2006 Hum. Mol. Genet.).
Πολλαπλασιασμός κεντροσωμάτων παρατηρείται σε διάφορες μορφές καρκίνου
και συνδέεται απευθείας με αστάθεια του γονιδιώματος. Προσπαθούμε
να προσδιορίσουμε το μοριακό μονοπάτι που οδηγεί σε πολλαπλασιασμό
κεντροσωμάτων κατά την απώλεια TSC1/TSC2 και την υπερ-ενεργοποίηση
του mTOR, και τις συνέπειες της απώλειας TSC1/TSC2 στη γονιδιωματική
σταθερότητα.
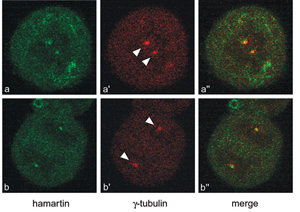 |
Εικόνα 3. Εικόνες συνεστιακής μικροσκοπίας κυττάρων HeLa
που δείχνουν συν-εντόπιση της αμαρτίνης (πράσινο) με τον κεντροσωματικό
δείκτη γ-σωληνίνη (κόκκινο) (Astrinidis
et al. 2006 Hum. Mol. Genet.).
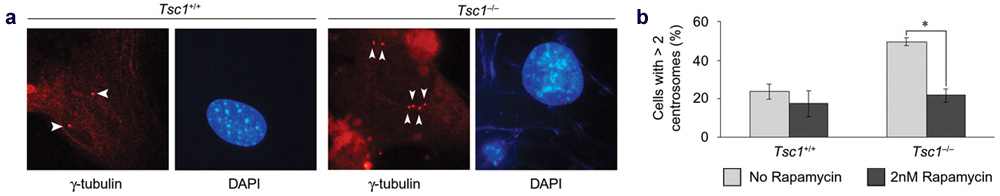
Εικόνα 4. (a) Μικρογραφίες ανοσοφθορισμού εμβρυϊκών ινοβλαστών
ποντικού (MEFs) γενότυπου Tsc1+/+
και Tsc1-/- μετά από χρώση
με γ-σωληνίνη (βέλη). Οι MEFs Tsc1-/-
έχουν αυξημένο αριθμό κεντροσωμάτων. (b) Προεπώαση των MEFs Tsc1-/-
με 2nM ραπαμυκίνης για 24 ώρες διασώζει τον φαινότυπο υπεράριθμων
κεντροσωμάτων. Ο αστερίσκος υποδηλώνει p<0.05 (Astrinidis
et al. 2006 Hum. Mol. Genet.).
Η ενεργοποίηση του mTOR αυξάνει την ανευπλοειδία
Ανώμαλος διπλασιασμός κεντροσωμάτων παρατηρείται σε διάφορες
μορφές καρκίνου και είναι άμεσα συνδεδεμένος με γενωματική αστάθεια.
Κύτταρα με ανεπάρκεια στην αμαρτίνη (TSC1) έχουν αυξημένο περιεχόμενο
DNA, που διασώζεται από τον αναστολέα του mTOR ραπαμυκίνη (Εικόνα
5).
Προσπαθούμε να προσδιορίσουμε το μοριακό μονοπάτι που οδηγεί σε
πολλαπλασιασμό κεντροσωμάτων κατά την απώλεια TSC1/TSC2 και την
υπερ-ενεργοποίηση του mTOR, και τις συνέπειες της απώλειας TSC1/TSC2
στη γενωματική σταθερότητα.
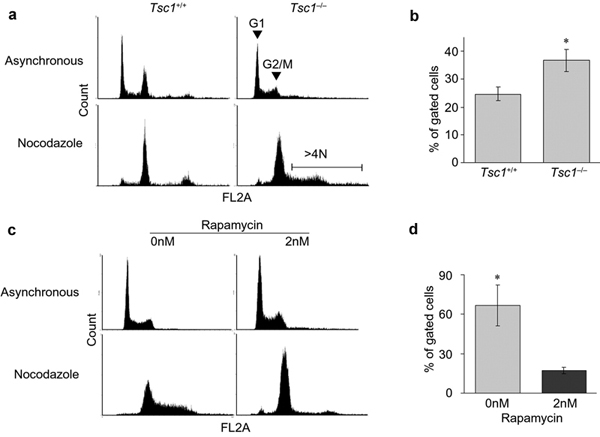 |
Εικόνα 5. (a) Προφίλ περιεχόμενου DNA (FL2) κυτταρομετρίας
ροής (FACS) κυττάρων MEFs γενότυπων Tsc1+/+ και Tsc1-/- μετά από
επώαση με DMSO (ασύγχρονα κύτταρα) ή nocodazole. (b) Επώαση των
MEFs Tsc1-/- με nocodazole αυξάνει το κλάσμα των κυττάρων με αυξημένο
(>4N) περιεχόμενο DNA. (c, d) Προεπώαση των MEFs γενότυπου Tsc1-/-
με 2nM ραπαμυκίνη διασώζει τον φαινότυπο αυξημένου περιεχόμενου
DNA (Astrinidis
et al. 2006 Hum. Mol. Genet.).
Χρηματοδότηση και ευαισθητοποίηση του κοινού
Η έρευνά μας χρηματοδοτείται από το Υπουργείο
Άμυνας των ΗΠΑ και από την Tuberous Sclerosis Alliance.
Χρηματοδότηση για την έρευνα στην TSC και την LAM δίνεται μέσω του
NIH,
και εξειδικευμένων προγραμμάτων όπως του Υπουργείου Άμυνας των ΗΠΑ
(Congressionally
Directed Medical Research Programs). Η Tuberous
Sclerosis Alliance, η LAM
Foundation και η LAM
Treatment Alliance δίνουν χρηματοδότηση για βασική, μεταφρασμένη
και κλινική έρευνα, και δραστηριοποιούνται έντονα για την αύξηση
της ευαισθητοποίησης όσον αφορά τις ασθένειες αυτές.
|